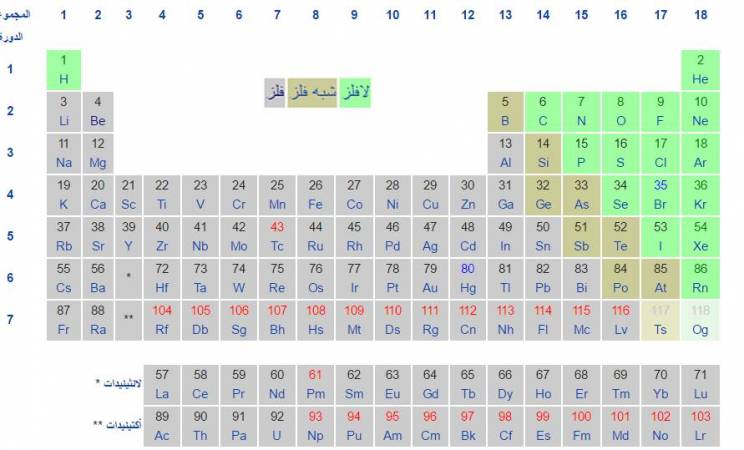
أين تقع الفلزات في الجدول الدوري
الفلزات هي فئة من المواد توجد في يسار ووسط الجدول الدوري تتميز بتوصيلها الجيد للكهرباء والحرارة، بالإضافة إلى الليونة وقابليتها للتطويع، وقدرتها الانعكاسية العالية للضوء، تعرف معنا على الفلزات وخواصها و أين تقع الفلزات في الجدول الدوري
الفلزات
– مجموعة من المواد تتميز بتوصيلها العالي للكهرباء والحرارة، وقدرتها الكبيرة على عكس الضوء، وليونتها.
– تشكل ما يقارب 3/4 العناصر الكيميائية المعروفة.
– يتواجد معظم هذه المواد بوفرة بالقشرة الأرضية مثل البوتاسيوم، والألمنيوم، والكالسيوم، والحديد، والمغنيسيوم، والصوديوم.
– تتواجد غالبية هذه المواد في حالتها الخام، إلا أن القليل منها يتواجد بشكل حر في الطبيعة مثل الذهب، والفضة والنحاس حيث أنها لا تتفاعل مع العناصر الأخرى بسهولة.
– يمكن اعتبار معظم الفلزات معادن يتم تجميعها معًا في منتصف الجانب الأيسر من الجدول الدوري، تتكون المعادن من الفلزات القلوية، والفلزات القلوية الترابية، والفلزات الانتقالية والفلزات الأساسية.
أين تقع الفلزات في الجدول الدوري ؟
– توجد المعادن أو الفلزات في منطقة وسط ويسار الجدول الدوري.
– تعتبر المجموعة IA والمجموعة IIA (الفلزات القلوية) هي أكثر المعادن نشاطًا.
– تعتبر العناصر الانتقالية، مجموعات IB إلى VIIIB من الفلزات.
– يعتبر عنصري اللانثانيدات والأكتينيدات الموجدان في أسفل الجدول الدوري من الفلزات.
خصائص الفلزات
– معظم العناصر الموجودة في الجدول الدوري تعتبر من المعادن بما في ذلك الذهب، والفضة، والبلاتين، والزئبق، واليورانيوم، والألمنيوم، والصوديوم، والكالسيوم، وتعتبر السبائك كالنحاس والبرونز من المعادن أيضاُ.
– تشترك المعادن في العديد من الخصائص المشتركة، تتمثل في:
1. صلبة في درجة حرارة الغرفة باستثناء الزئبق.
2. لامعة.
3. نقطة انصهارها عالية.
4. موصل جيد للحرارة.
5. موصل جيد للكهرباء.
6. طاقة تأينها منخفضة.
7. الطاقة الكهرومغناطيسية لديها منخفضة.
8. مرنه أو لينة يمكن إعادة تشكيلها.
9. قابلة للسحب والطرق.
10. كثافتها عالية باستثناء الليثيوم والبوتاسيوم والصوديوم.
11. تتآكل في الهواء أو مياه البحر.
12. تفقد الإلكترونات في التفاعلات.
قد يعجبك:
الفلزات في الجدول الدوري
تقسم الفلزات في الجدول الدوري لعدة مجموعات تتمثل في:
-
الفلزات القلوية
– توجد المعادن القلوية في المجموعة IA في أقصى الجانب الأيسر من الجدول الدوري.
– تتميز بأنها عناصر شديدة التفاعل، ومميزة بسبب عدد التأكسد الخاص بها وهو +1، كثافتها منخفضة بشكل عام مقارنة بالمعادن الأخرى.
– تم العثور على هذه العناصر في المركبات لأنها شديدة التفاعل.
– تتمثل في الليثيوم، الصوديوم، البوتاسيوم، روبيديوم، السيزيوم، والفرانسيوم.
-
الفلزات القلوية الترابية
– تم العثور عليها في المجموعة IIA من الجدول الدوري في العمود الثاني من العناصر.
– كل ذرات الفلزات القلوية الترابية لها عدد تأكسد خاص بها وهو +2.
– توجد هذه العناصر في مركبات وليس في شكل نقي مثل الفلزات القلوية.
– هذه المعادن تفاعلية لكنها أقل تفاعلًا من الفلزات القلوية.
– تتميز بأنها صلبة، ولامعة، وعادة ما تكون مرنة، وقابلة للدهن.
– تتمثل في البريليوم، المغنيسيوم، الكالسيوم، السترونتيوم، الباريوم، الراديوم.
-
الفلزات الأساسية
– تعرض هذه الفلزات الأساسية الخصائص التي يقوم الناس بربطها بمصطلح معدن.
– تتميز بأنها موصل جيد للحرارة والكهرباء، كما أن لها بريق معدني، وتميل لأن تكون كثيفة، ومرنة، وقابلة للطرق والسحب.
– تتمثل في القصدير، الغاليوم، الألومنيوم، الجاليوم، والثاليوم.
-
الفلزات الانتقالية
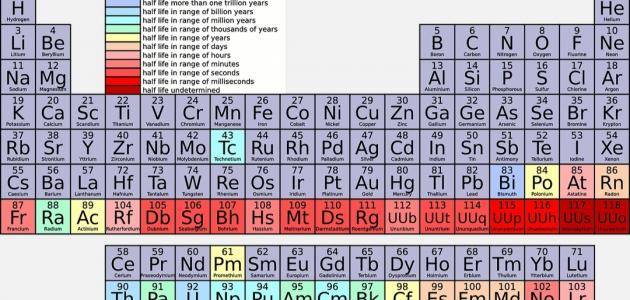
– تتميز الفلزات الانتقالية بامتلاكها قشور إلكترونية مملوءة بشكل جزئي لذلك فإن هذه العناصر تمتلك حالات أكسدة متعددة، وغالبًا ما تنتج مركبات ملونة.
– يمكن أن توجد في شكل نقي أو أصلي مثل الفضة والذهب والنحاس، أو توجد على شكل مركبات مثل اللانثانيدات والأكتينيدات.
– تتمثل في السكانديوم، التيتانيوم، الفاناديوم، الكروم، المنغنيز، الحديد، الكوبالت، النيكل، النحاس، الزنك، الروديوم، البلاديوم، الفضة، البلاتين، الذهب، الزئبق، والسيريوم.