الاختلاف بين الأحماض الضعيفة والأحماض القوية
يمكن تصنيف العديد من المواد الكيميائية على أنها حمضية أو محايدة أو قلوية باستخدام المؤشرات، ويستخدم مقياس الأس الهيدروجيني لقياس الحموضة والقلوية، وعندما يتم تحييد الحمض، فإنه يشكل ملحًا، وفي هذا المقال سنذكر الاختلاف بين الأحماض الضعيفة والأحماض القوية.
الاختلاف بين الأحماض الضعيفة والأحماض القوية
- الأحماض عبارة عن مواد كيميائية تتبرع بأيونات الهيدروجين أو البروتونات عند مزجها في المحاليل، ويحدد عدد البروتونات المنبعثة من حمض معين في الواقع قوة الحمض، سواء كان حمضًا قويًا أو حمضًا ضعيفًا.
- ولفهم قوة الأحماض، يحتاج المرء إلى مقارنة ميلها للتبرع بالبروتونات إلى القاعدة المماثلة وهي الماء في الغالب، ويتم الإشارة إلى القوة بواسطة رقم يسمى pKA.
ما هو الحمض القوي
- يقال أن الحمض قوي إذا انفصل أو تأين تمامًا في محلول، وهذا يعني أنه قادر على إعطاء أكبر عدد من أيونات H + أو البروتونات عند مزجه في المحلول، وتعتبر هذه الأيونات هي الجسيمات المشحونة.
- ونظرًا لأن الحمض القوي يتبرع بعدد أكبر من الأيونات أثناء تكسيره أو تأينه، فهذا يعني أن الحمض القوي هو موصل للكهرباء.
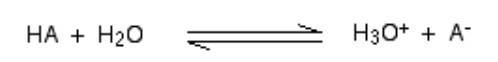
- وعندما يمتزج حمض في H2O، يتم نقل البروتون (H + أيون) إلى جزيء H2O لتوليد H3O + (أيون الهيدروكسونيوم) وأيون على أساس أي حمض متورط في البداية.
- وفي حالات قليلة، يُخرج الحمض أيون H + بسهولة، ويبدو أن التفاعل أحادي الاتجاه، والحمض مفكك تمامًا.
- على سبيل المثال، عندما يذوب كلوريد الهيدروجين في H2O لتكوين حمض الهيدروكلوريك، يحدث القليل من التفاعل العكسي بحيث يمكننا كتابة:
- في وقت واحد، سيحدث تفاعل افتراضي بنسبة مائة بالمائة حيث يظهر كلوريد الهيدروجين تفاعلًا مع H3O + (أيون الهيدروكسونيوم) وكلوريد الكلوريد، وهنا، الحمض القوي هو كلوريد الهيدروجين.
ما هو الحمض الضعيف
- يقال أن الحمض يكون ضعيفًا إذا تأين جزئيًا أو غير كامل، مما يعطي فقط بعض ذرات الهيدروجين في المحلول، وبالتالي، فهي أقل قدرة مقارنة بالحمض القوي في إطلاق البروتونات، وتحتوي الأحماض الضعيفة على نسبة أعلى من pKa من الأحماض القوية.
- ويعتبر حمض الإيثانويك مثال جيد للحمض الضعيف، كما يظهر التفاعل مع H2O لإنتاج H3O + (أيونات الهيدروكسونيوم) و CH3COOH (أيونات الإيثانوات)، لكن التفاعل العكسي يظهر نجاحًا أكبر من التفاعل الأمامي، كما تتفاعل الجزيئات بسهولة تامة لتحسين الحمض و H2O.

- وفي أي وقت، يظهر تحويل واحد بالمائة فقط من جزيئات حمض CH3COOH إلى أيونات، كل ما تبقى هو جزيئات حمض الخليك البسيطة تسمى بشكل منهجي حمض الإيثانويك.
الفرق بين حمض قوي وحمض ضعيف
حمض قوي
- الحمض القوي هو حمض يتأين تمامًا في محلول مائي، ووقتها سوف يفقد الحمض القوي دائمًا البروتون (A H +) عندما يذوب في H2O، وبمعنى آخر، يكون الحمض القوي دائمًا على أصابع قدميه وفعال جدًا في إخراج البروتونات.
- من حيث التوصيل الكهربائي ستظهر الأحماض القوية دائمًا موصلية قوية، فعادةً ما تمرر الأحماض القوية تيارًا أكبر مقارنةً بالأحماض الضعيفة لنفس الجهد والتركيز.
- من ناحية نسبة التفاعل في حالة الحامض القوي يكون معدل التفاعل أسرع في الأحماض القوية.
- ومن أمثلة الحامض القوي، حمض الهيدروكلوريك (HCl)، وحمض النيتريك (HNO3)، وحمض البيركلوريك (HClO4)، وحمض الكبريتيك (H2SO4)، وحمض Hydroiodic (HI)، وحمض الهيدروبروميك (HBr)، وحمض الكلوريك (HClO3).
- اما عن الرقم الهيدروجيني في حالة الحامض القوي، يكون الرقم الهيدروجيني أقل من 3 بشكل عام.
- كما تمتلك الأحماض القوية تركيزًا عاليًا جدًا من أيونات H + (يحتوي الحمض الذي يحتوي على درجة حموضة 3 على 0.001 مول لكل لتر من أيونات الهيدروجين).
- أما عن قيمة pKa في الحمض القوي، فهي تكون منخفضة جدًا.
- وبالنسبة إلى التفكك في الحامض القوي HCl (g) + H2O (l) ≈ H3O + (aq) + Cl− (عبد القدير)
الحمض الضعيف
- الحمض الضعيف هو الذي يتأين جزئيًا في محلول، ويعطي فقط القليل من ذرات الهيدروجين في المحلول، ومن ثم فهو أقل قدرة من حمض قوي.
- من حيث التوصيل الكهربائي الأحماض الضعيفة لها موصلية منخفضة، فهي تعتبر موصلات ضعيفة وتظهر قيمة منخفضة لتمرير التيار.
- من ناحية نسبة التفاعل معدل التفاعل أبطأ في الأحماض الضعيفة.
- ومن أمثلة الحمض الضعيف، حامض الكبريتيك (H2SO3)، حامض الخليك (CH3COOH)، حامض الفوسفوريك (H3PO4)، حمض البنزويك (C6H5COOH)، حمض الهيدروفلوريك (HF)، حمض الفورميك (HCOOH)، حمض النيتروز (HNO2).
- أما عن الرقم الهيدروجيني فالحمض الضعيف له درجة حموضة تتراوح بين 3-7.
- وبالنسبة إلى قيمة pKa في الحمض الضعيف، فهي تكون عالية جدًا.
- وعن التفكك في حمض ضعيف CH3COOH (l) + H2O (l) ≈ H3O + (aq) + CH3COO− (aq)
لماذا الأحماض الضعيفة ضعيفة
- يعتمد تأين الحمض تمامًا في الماء على قطبية أو توزيع الإلكترونات في رابطة كيميائية، حيث أنه عندما تمتلك ذرتان في رابطة ما نفس قيم الكهربية تقريبًا، يتم مشاركة الإلكترونات بالتساوي وتقضي كميات متساوية من الوقت مرتبطة بأي من الذرات (رابطة غير قطبية).
- من ناحية أخرى، عندما يكون هناك فرق كبير في الكهربية بين الذرات، يكون هناك فصل في الشحنة؛ نتيجة لذلك، يتم سحب الإلكترونات إلى ذرة واحدة أكثر من الأخرى (الرابطة القطبية أو الرابطة الأيونية).
- تحتوي ذرات الهيدروجين على شحنة موجبة طفيفة عند ارتباطها بعنصر كهرسلبي، إذا كانت هناك كثافة إلكترون أقل مرتبطة بالهيدروجين، كما يصبح من السهل تأينها ويصبح الجزيء أكثر حمضية.
- تتشكل الأحماض الضعيفة عندما لا يكون هناك قطبية كافية بين ذرة الهيدروجين والذرة الأخرى في الرابطة للسماح بإزالة أيون الهيدروجين بسهولة.
- عامل آخر يؤثر على قوة الحمض هو حجم الذرة المرتبطة بالهيدروجين، فكلما زاد حجم الذرة، تقل قوة الرابطة بين الذرتين، هذا يجعل من السهل كسر الرابطة لتحرير الهيدروجين ويزيد من قوة الحمض.
اقرا ايضا: من أدلة حدوث تفاعل كيميائي