العلاقة بين عدد مستويات الطاقة الرئيسية والعدد الذري في الدورة الثالثة
إن تحديد العلاقة بين عدد مستويات الطاقة الرئيسية والعدد الذري في الدورة الثالثة أمر في غاية الأهمية. حيث يعتمد ترميز الإلكترون في الذرة وحركته أيضًا على نوع مستويات الطاقة. كما تحتوي مستويات الطاقة الرئيسية على عدد معين من مستويات الطاقة الثانوية. لذلك كلما ازداد عدد مستويات الطاقة الرئيسية كلما ازداد أيضًا عدد المستويات الثانوية وذلك حتى المستوى الرئيسي الرابع.
قد يهمك أيضًا: حقائق عن الجدول الدورى …تعرف على الجدول الدورى خصائصه والعناصر الموجودة به
العلاقة بين عدد مستويات الطاقة الرئيسية والعدد الذري في الدورة الثالثة
ما هي مستويات الطاقة
قد يهمك أيضًا: مصطلحات علم الكيمياء
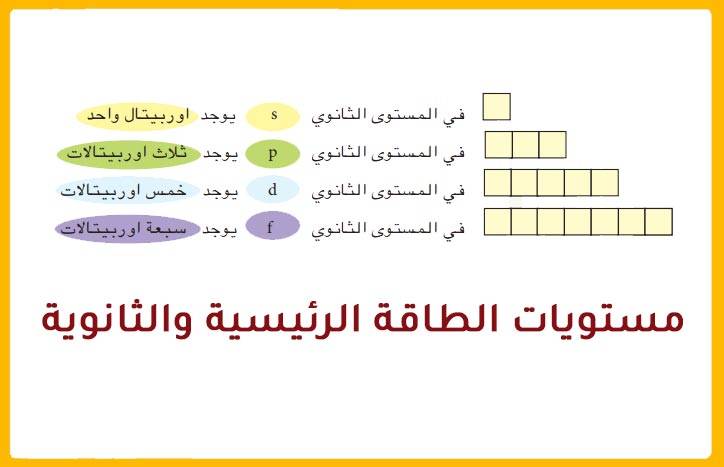
يشير مفهوم مستوى الطاقة الرئيسي للإلكترون إلى الغلاف أو المدار الذي يدور فيه الإلكترون حول نواة الذرة. ويرمز إلى مستويات الطاقة الرئيسية بالرمز n. ويتمثل مستوى الطاقة في المسافة المحددة بين نواة الذرة وموقع الإلكترونات السالبة الشحنة حول النواة موجبة الشحنة. كذلك تحتوي المستويات الرئيسية على مستويات أخرى فرعية بناء على أقصى عدد من الإلكترونات في مستوى الطاقة الرئيسي. ويمكن تشبيه مستويات الطاقة الرئيسية بدرجات السلم حيث يمكننا أن نقف على الدرجة الأولى أو الثانية من السلم ولكن لا يمكننا الوقوف بينهما. كذلك الأمر بالنسبة لحركة الإلكترونات حيث يمكن أن تكون في مستويات الطاقة الرئيسية ولكن لا يمكن أن تتواجد في الفراغات الموجودة بين هذه المستويات. كما أن كل مستوى طاقة رئيسي لديه طاقة معينة، مما يجعل مستوى الطاقة الأول هو الأقل طاقة بين جميع المستويات. لذلك كلما ارتفع المستوى زادت طاقته.
قد يهمك أيضًا: مصطلحات علم الحركة
ما هو العدد الذري
تتكون العناصر الكيميائية من ذرات تحمل كل واحدة منها شحنات إلكترونية. كما تمتلك كل ذرة نواة مكونة من بروتونات موجبة الشحنة ونترونات حيادية. لذلك فإن العدد الذري هو عدد البروتونات موجبة الشحنة الموجودة في نواة الذرة. ويتساوى عدد البروتونات داخل النواة بعدد الإلكترونات التي تدور حول النواة. ويرمز إلى العدد الذري بالرمز Z الذي يمكن من خلاله معرفة عدد البروتونات التي تحتوي عليها النواة بمجرد قراءة العدد الذري لأي عنصر. فعلى سبيل المثال تحتوي ذرات عنصر الهيدروجين على بروتون موجب واحد فقط، بالتالي فإن العدد الذري لعنصر الهيدروجين هو 1 وهو عدد ثابت غير متغير أبدًا. في النهاية يمكن تمثيل قاعدة محددة تربط جميع هذه المفاهيم ببعضها البعض وهي:
- العدد الذري = عدد البروتونات = عدد الإلكترونات
قد يهمك أيضًا: ماهي الجسيمات ذات الشحنة السالبة في الذرة
ما هي الدورة الثالثة
الدورة في الجدول الدوري للعناصر تسمى period وتمثل الصف الأفقي في الجدول الدوري. ويحدد عدد الإلكترونات الموجودة في آخر مستويات طاقة الذرة إلى أي دورة ينتمي العنصر. وذلك لأن كل غلاف من أغلفة الطاقة الرئيسية ينقسم إلى عدة مستويات فرعية. وتمتلئ هذه المستويات الفرعية كلما زاد العدد الذري للعنصر. وهكذا فإن المجموعة الثالثة في الجدول الدوري هي العمود الثالث عشر في الجدول الدوري والصف الثالث، وتسمى بمجموعة البورون لأنها تضم عناصر فلزية. كما أن أهم ما يميزها والسبب في تسميتها بالمجموعة الثالثة هو أن جميع عناصرها تحتوي على ثلاثة إلكترونات في الغلاف الخارجي للمدار الأخير.
قد يهمك أيضًا: أين تقع العناصر الانتقالية في الجدول الدوري
ما هي العلاقة بين عدد مستويات الطاقة الرئيسية والعدد الذري في الدورة الثالثة
الآن، وبعد أن تعرفنا على مفهوم كلًا من مستويات الطاقة والعدد الذري والدورة الثالثة، فما هي العلاقة بينهم جميعًا؟ إن كل إلكترون في الذرة له توقيع للطاقة يحدد بواسطة علاقته بنواة الذرة موجبة الشحنة. وبالتالي يمكن للإلكترون أن يتنقل بين مستويات الطاقة ولكن بكميات محددة. فكلما ابتعد الإلكترون عن النواة؛ كلما زادت طاقته. وكلما انخفض عدد مستويات الطاقة الأساسية؛ كلما اقترب الإلكترونات من بعضها البعض ومن نواة الذرة. لذلك كلما زاد العدد الذري للعنصر في الدورة الثالثة؛ ازداد عدد الإلكترونات الموجودة في مستوى الطاقة الخارجي. وبذلك تزداد قوة جذب النواة لإلكترونات المستوى الأخير وبالتالي يقل الحجم الذري. وهكذا نرى العلاقة بين عدد مستويات الطاقة الرئيسية والعدد الذري لعناصر الدورة الثالثة.
قد يهمك أيضًا: ما الفرق بين ميكانيك الكم والفيزياء الكلاسيكية