رتب علماء الكيمياء العناصر الكيميائية ونظموها في الجدول الدوري وفقاً للعدد الذري والخصائص الكيميائية لكل عنصر، ثم قاموا بتقسيم الجدول لمجموعات رئيسية تحتوي كل مجموعة منها على العناصرَ الكيميائيةً التي تتشارك مع بعضها البعض في الصفات، ومن بين هذه المجموعات العناصر الانتقالية التي تشتمل على المعادن، تعرف معنا على العناصر الانتقالية، و أين تقع العناصر الانتقالية في الجدول الدوري
الجدول الدوري
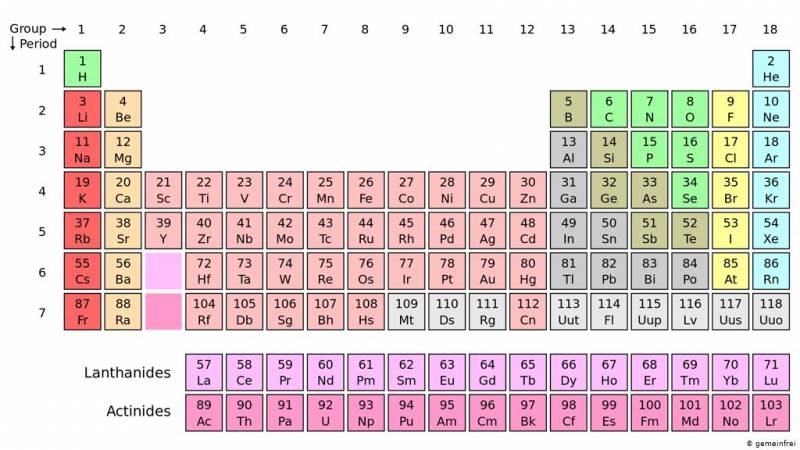
- جدول يضم العناصر الكيميائية المعروفة مرتبة على هيئة صفوف وأعمدة من اليسار لليمين، ومن الأعلى للأسفل تبعاً للزيادة في العدد الذري للعناصر – العدد الإجمالي للبروتونات في النواة الذرية – .
- ترتيب العناصر الكيميائية على هذا النحو يجعل هناك نمط متكرر يسمى “القانون الدوري” في خصائصها، حيث العناصر في نفس العمود (المجموعة) لها خصائص متشابهة.
- بدأ مُنشئ الجدول الدوري ديمتري مندليف في عام 1869 بجمع وفرز الخصائص المعروفة للعناصر، لعب هذا الجدول دور لا يقدر بثمن في تطوير الكيمياء.
العناصر الانتقالية
- أكبر مجموعة من العناصر في الجدول الدوري.
- معدن انتقالي من العناصر الكيميائية المختلفة التي تحتوي على إلكترونات تكافؤ – أي الإلكترونات التي يمكن أن تشارك في تكوين الروابط الكيميائية – في غلافين بدلاً من غلاف واحد فقط.
- في حين أن مصطلح الانتقال ليس له أهمية كيميائية معينة، إلا أنه اسم مناسب يمكن من خلاله التمييز بين تشابه الهياكل الذرية، والخصائص الناتجة للعناصر المحددة على هذا النحو.
أسماء العناصر الانتقالية
- التيتانيوم، عدده الذري 22، يرمز له بالرمز Ti.
- فاناديوم، عدده الذري 23، يرمز له بالرمز V.
- الكروم، عدده الذري 24، يرمز له بالرمز Cr.
- المنغنيز، عدده الذري 25، يرمز له بالرمز Mn.
- الحديد، عدده الذري 26، يرمز له بالرمز Fe.
- الكوبالت، عدده الذري 27، يرمز له بالرمز Co.
- النيكل، عدده الذري 28، يرمز له بالرمز Ni.
- النحاس، عدده الذري 29، يرمز له بالرمز Cu.
- الزنك، عدده الذري 30، يرمز له بالرمز Zn.
- زركونيوم، عدده الذري 40، يرمز له بالرمز Zr.
- النبيوبيوم، عدده الذري 41، يرمز له بالرمز Nb.
- موليبنوم، عدده الذري 42، يرمز له بالرمز Mo.
- تكنيشيوم، عدده الذري 43، يرمز له بالرمز Tc.
- الروثينيوم، عدده الذري 44، يرمز له بالرمز Ru.
- الروديوم، عدده الذري 45، يرمز له بالرمز Rh.
- بالاديوم، عدده الذري 46، يرمز له بالرمز Pd.
- الفضة، عدده الذري 47، يرمز له بالرمز Ag.
- كادميوم، عدده الذري 48، يرمز له بالرمز Cd.
- هافنيوم، عدده الذري 72، يرمز له بالرمز Hf.
- تانتالوم، عدده الذري 73، يرمز له بالرمز Ta.
- نتجستن، عدده الذري 74، يرمز له بالرمز W.
- رينيوم، عدده الذري 75، يرمز له بالرمز Re.
- أوزميوم، عدده الذري 76، يرمز له بالرمز Os.
- إريديوم، عدده الذري 77، يرمز له بالرمز Ir.
- بلاتين، عدده الذري 78، يرمز له بالرمز Pt.
- ذهب، عدده الذري 79، يرمز له بالرمز Au.
- زئبق، عدده الذري 80، يرمز له بالرمز Hg.
- رذرفورديوم، عدده الذري 104، يرمز له بالرمز Rf.
- دوبنيوم، عدده الذري 105، يرمز له بالرمز Db.
- سيبورغيوم، عدده الذري 106، يرمز له بالرمز Sg.
- بوريوم، عدده الذري 107، يرمز له بالرمز Bh.
- هاسيوم، عدده الذري 108، يرمز له بالرمز Hs.
- مايتنريوم، عدده الذري 109، يرمز له بالرمز Mt.
- دارمشتاتيوم، عدده الذري 110، يرمز له بالرمز Ds.
- رونتيجينيوم، عدده الذري 111، يرمز له بالرمز Rg.
- كوبرنيسيوم، عدده الذري 112، يرمز له بالرمز Cn.
أين تقع العناصر الانتقالية في الجدول الدوري
- تقع العناصر الانتقالية في منتصف الجدول الدوري، وتعتبر أكبر مجموعة من العناصر في الجدول.
- تشغل هذه العناصر الأجزاء الوسطى من الدورات الطويلة للجدول الدوري بين المجموعات على الجانب الأيسر والمجموعات على الجانب الأيمن، على وجه التحديد يشكلون المجموعات 3 (IIIb) إلى 12 (IIb).
خصائص المعادن الانتقالية
- موصلات ممتازة للحرارة والكهرباء.
- قابلة للطرق (من السهل تشكيلها أو ثنيها).
- تميل هذه المعادن لأن تكون شديدة الصلابة.
- تبدو لامعة ومعدنية، فمعظمها لونها رمادي أو أبيض (مثل الحديد أو الفضة)، لكن الذهب والنحاس لهما ألوان لم تظهر في أي عنصر آخر في الجدول الدوري.
- لها نقاط انصهار عالية كمجموعة، ما عدا الزئبق فهو سائل عند درجة حرارة الغرفة.
- تحتوي هذه العناصر على نقاط غليان عالية.
اقرأ: تعريف علم الكيمياء لغة واصطلاحا
- تحتوي ذراتها على طاقات تأين منخفضة.
- تشكل تجمعات ملونة، لذلك محاليلها، أو مركباتها تكون ذات لون.
- تتميز بأنها عناصر تفاعلية، ولكنها أقل تفاعلًا من العناصر القلوية.
- تشكل العديد من المعادن الانتقالية مركبات شبه مغناطيسية.